Aplicații de acid sulfuric - studopediya
Acid sulfuric grad comercial
Acid sulfuric
In tehnica sub acid sulfuric înțeleg orice amestecuri de trioxid de sulf cu apă, de fapt anhidru acid sulfuric H2 SO4 numit monohidrat, SO3 dizolvat în 100% H2 SO4 numit oleum.
Proprietăți fizice. Acid sulfuric anhidru (monohidrat) - lichid incolor, uleios, cu Tcr = 10.37 ° C. Tc = 296,2 ° C # 961; = 1,85 g / cm3 nu fumează, nu are nici o culoare și miros, amestecat cu apă și anhidridă sulfurică în toate proporțiile. Atunci când amestecarea este format dintr-o serie de compuși cu temperaturi diferite de cristalizare.
Industria modernă produce mai multe grade comerciale de acid sulfuric și oleum, caracterizat prin concentrarea și puritatea:
Aceste compoziții clase de acid sulfuric vandabil identificat ca având cea mai scăzută temperatură de cristalizare. acest lucru se face pentru a se evita cristalizarea acidului sulfuric în timpul transportului și depozitării acesteia.
Printre acizii minerali, produse de industria chimică, acid sulfuric în ceea ce privește producția și consumul clasat pe primul loc. producția mondială de acid sulfuric este în prezent 160 de milioane. tone pe an.
Acid sulfuric concentrat nu distruge metale feroase. În același timp, acidul sulfuric este unul dintre cei mai puternici acizi minerali.
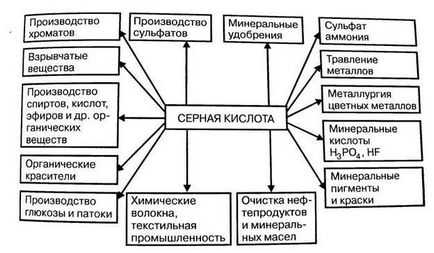
1) Acidul sulfuric este utilizat pe scară largă în producția de îngrășăminte fosfat. săruri și acizi diferiți. În producția de îngrășăminte minerale se consumă până la 50% din acidul sulfuric produs.
2) Un număr mare (până la 10%) de acid sulfuric a fost utilizat pentru purificarea petrolului și a metalelor neferoase.
3) În industria metalurgică, acidul sulfuric este utilizat pentru îndepărtarea ruginii de pe suprafețe metalice feroase înainte de acoperirea lor cu lacuri de protecție și metale neferoase.
4) Acid sulfuric diluat și sărurile sale sunt folosite în producția de coloranți (până la 15%), lacuri; Medicamente, detergenți, substanțe explozive, în industria textilă și producția de fibre chimice.
5) Deoarece producerea catalizatorului în hidroliza
6) un agent de deshidratare în uscarea gazelor
Materiile prime pentru producerea de acid sulfuric.
Trebuie subliniat faptul că, în timpul prelucrării metalelor sulfidovtsvetnyh o cantitate mare de oxid de sulf (IV) (10%), care ar putea fi utilizate în mod direct pentru producerea de acid sulfuric.
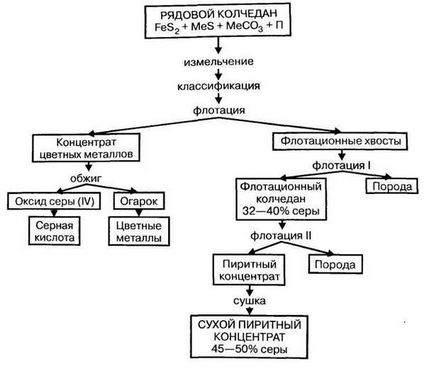
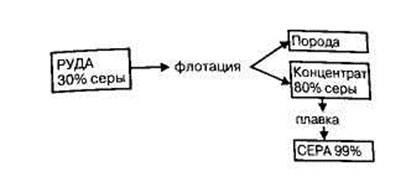
2) sulf liber (S) este cel mai avansat materie primă pentru producerea de acid sulfuric. Sulf ușor ars în fluxul de aer, fără formarea de deșeuri și produse secundare. Sulful elementar poate fi obținut din minereuri de sulf sau gaze care conțin hidrogen sulfurat sau oxid de sulf (IV). distinge în mod corespunzător de sulf nativ și gaz de sulf (umflătură). sursă de sulf gazoasa sunt depozite și depozite de condensat de gaze asociate gaza.Iz minereurilor de sulf native sunt topiți în cuptoare, autoclave sau direct în rezervoare subterane (metoda Frasch). Pentru acest sulf topit direct sub supraîncălziți de pompare a apei în puț și sulf topit este extrudat pe suprafața comprimată vozduhom.Na figura prezintă schema de preparare a sulfului nativ.
3) hidrogen sulfurat. În timpul prelucrării petrolului subprodus hidrogen sulfurat format. hidrogen sulfurat și servesc ca sursă de alte gaze combustibile: cocs, generator, care trece. Hidrogen sulfurat capcană, concentrat, și apoi ars pentru a da oxid de sulf (IV), prelucrate ulterior acid sulfuric.
3.3. PRODUCEREA DE ACID SULFURIC fabricarea acidului sulfuric din materii prime conținând sulf implică mai multe procese chimice: 1. Prima etapă a oricărei instalații de acid sulfuric este de a produce sulf SO2 dioxid de sulf prin arderea materiei prime. 2. sulfuros în continuare curățat cu grijă (în special în cazul metodei de contact), este oxidat la trioxid de sulf. 3. Absorbția trioxid de sulf cu apă pentru a forma SO2 sulfuric SO3 kisloty.Okislenie în condiții normale este lent. Catalizatori utilizate pentru a accelera această etapă a procesului.
În metoda de contact a produce oxidarea SO2 acid sulfuric la SO3 se realizează pe masa de contact solid. Atunci când catalizatorii metodă nitroase sunt oxizii de azot, oxidarea se efectuează în fază lichidă, în turnurile ambalate, așa numita metodă turn azotos. gazele atmosferice de evacuare a poluării (SO2, SO3 NO2 ..) de producție turn și o calitate slabă a acidului - o cauza majora deplasare metoda azotos.
SO2 + NO2 + H2O = H2 SO4 + NO; 2NO + O2 = 2NO2. În producția reală a acestor procese chimice sunt adăugate la procesele de preparare a materiilor prime, în cuptor cu gaz și curățarea anumitor alte operațiuni de fabricație. În general, schema de producție de acid sulfuric poate fi exprimată după cum urmează: Materii prime ®podgotovka ® ® calcinarea purificare cuptor gaz brut ®
Contactarea ® ® ® sulfuric schema tehnologică de producție kislotaKonkretnaya contact de absorbție a gazului depinde de tipul de materie primă, caracteristicile oxidarea catalitică a SO2. prezența sau absența etapei de absorbție a oxidului de sulf SO3.