Determinarea greutății echivalente și echivalentul metalului pe hidrogen
Obiectiv: practic, să învețe în mod empiric pentru a identifica echivalente și greutatea echivalentă a volumului de metal al gazului separat în cursul reacției. A învăța cum de a efectua diverse calcule folosind drept echivalente raționale.
Din legea compoziție constantă, raportul de volum multiplu implică faptul că elementele sunt conectate între ele în proporții strict definite care numite echivalente sau greutăți echivalente.
Pentru determinarea echivalenților și greutăți echivalente trebuie să știe ce mol și masa molară.
Mol este numărul de substanțe, care conține un număr definit de particule de orice fel, constant egal Avogadro (6.02. 23. octombrie). De exemplu: 3. 24 octombrie moleculele de apă va fi de 5 mol.
Mole (molar) masa substanței în grame numeric egală cu masa relativă moleculară (atomică), exprimată în unități atomice de masă (uam). Greutatea 1 mol de substanță este exprimată în g / mol. De exemplu: masa molară a H2O și greutatea atomică a oxigenului sunt, respectiv, 18 și 16 amu masa lor molară egală cu 18 g / mol și 16 g / mol. Ekvivalentomelementa se înțelege o cantitate, care este conectată 1c mol de atomi de hidrogen sau înlocuiește același număr de atomi de hidrogen în reacții chimice. De exemplu, în compușii cu HBr, H2O, echivalenți PH3 de brom, oxigen, fosfor, respectiv, sunt egale cu 1 mol, 2,1 mol și 1/3 mol.
Greutatea unui echivalent se numește greutatea sa echivalentă. Astfel, în exemplele de mai sus, greutatea echivalentă de brom, oxigen, fosfor, respectiv, 79,9 g / mol, 16: 2 = 8 g / mol, 31: 3 = 10,3 g / mol.
Echivalentul unui compus numit suma acestora, care interacționează fără reziduuri cu un echivalent de hidrogen sau un echivalent de orice altă substanță. Calculele referitoare la definirea masei echivalente, condusă de echivalente de drept. masă (volum) reacția cu fiecare alte substanțe care sunt proporționale cu greutățile lor echivalente (volum). Matematic, legea exprimată de relația:
unde: m, (V) - masă (volum) a reactanților;
E, (Vekv.) - echivalentă cu greutatea (volum).
Greutatea echivalentă a unei substanțe simplu poate fi calculat prin formula:
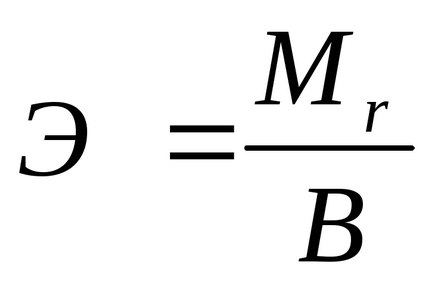
unde
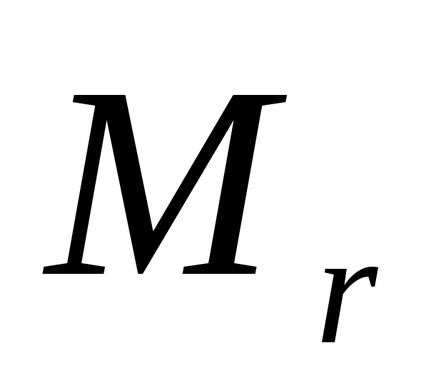
B - valenta elementului.
De exemplu, greutatea echivalentă de hidrogen și oxigen sunt, respectiv:
Un volum echivalent de gaz poate fi calculat prin formula:
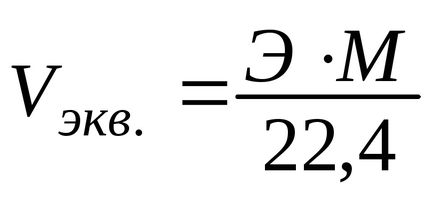
De exemplu, volume echivalente de hidrogen și oxigen sunt, respectiv:
substanțe complexe de greutate echivalentă poate fi calculată prin formulele:
nO, nOH, nH, NME - numărul de atomi de oxigen, grupări hidroxil, atomi de hidrogen, respectiv, în baza de oxid de metal, săruri acide; B - valența 8 - greutate echivalentă de oxigen, 1 - greutate echivalentă de hidrogen, 17 - greutatea echivalentă a grupării hidroxil.
In acest studiu definiția de metal greutate echivalentă bazată pe măsurarea volumului de hidrogen, metalul activ deplasat din acid diluat. Un volum măsurat de hidrogen în condițiile experimentului este dată condiții normale:
Apoi, din formula (1) se determină greutatea echivalentă.
Figura dispozitiv și descris pentru ue definirea echivalentului metalului
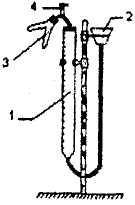
Dispozitiv 1 constă dintr-o biuretă conectat prin tuburi de cauciuc într-o pâlnie de 2 și 3. Dispozitiv dvuhkolennoy tampon este montat pe un trepied Bunsen.
Reactivi și articole din sticlă.
Dispozitiv pentru determinarea metalului echivalent (Fig.1.1), barometru, termometru cilindru gradat de 10 ml capacitate, pâlnie, 10% - soluție de acid clorhidric a fost magneziu metalic.
1. Într-un genunchi tub de umplere de magneziu 3, iar în celălalt tub genunchi prin pâlnie, turnați aproximativ 12ml de 10% - soluție tărie de acid clorhidric. Dvuhkolennuyu Pune tub pe tub, un tub de cauciuc conectat cu o biuretă.
2. O condiție necesară pentru experiența de curgere este etanșeitatea întregului sistem, deci verificați aparatul pentru scurgeri. Pentru această pâlnie inferioară 2 sau ridica 25-30 cm și se menține la același nivel 1 -2 minute. În cazul în care nivelul apei din biureta 1 nu se schimbă în acest timp, dispozitivul sigilat. În cazul în care nivelul apei din biuretă va scădea sau crește până la nivelul apei din canal, mișcările de rotație Ia un ajustaj toate tuburile și verificați din nou etanșeitatea dispozitivului.
3. Atunci când dispozitivul de închidere, verificați nivelul apei din biureta 1 și apoi, treptat (prima porțiune de acid ar trebui să fie mică, pentru a evita evoluția rapidă a gazului) dvuhkolennuyu înclinați tubul astfel încât acidul revărsat în genunchi cu magneziu.
4. După reacție, așteptați 1 minut, până la temperatura camerei va gazului și se măsoară cantitatea de magneziu reprimată hidrogen. Pentru această pâlnie fixată la o înălțime astfel încât apa din pâlnie și biureta a fost la același nivel, adică de gaz a fost la presiune atmosferică. Despartitor biuretă împotriva căreia nivelul apei stabilit va corespunde volumului de hidrogen evoluat în condițiile experimentului. (Dacă la începutul nivelului de experiență a apei nu a fost la zero, sfârșitul citirile nivelului apei este necesară pentru a scădea numărul care corespunde nivelului inițial de apă). În tabelul 1.1, nota valorile indicate în valorile sale.
Tabelul 1.1 Parametrii pentru calculul echivalentului metalului.
T 0 - temperatura, în condiții normale, care este egală cu 273 K.
Scrieți reacția de magneziu ecuație cu acid clorhidric.
Măsurat cantitatea V de hidrogen în condiții normale aduc pe ecuația Clapeyron (3):
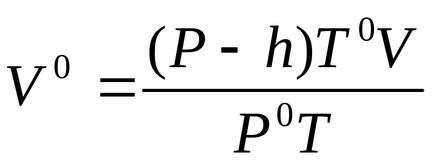
Din expresie matematică (1) echivalenților magneziu definesc greutate echivalentă:
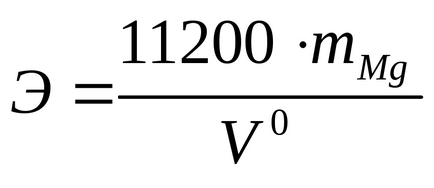
Se determină valoarea teoretică a greutății echivalente de magneziu cu formula:
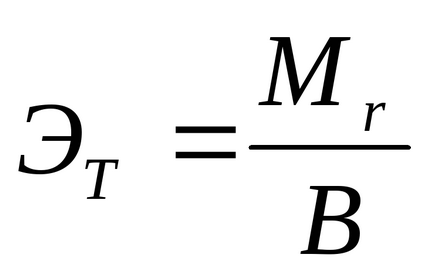
unde
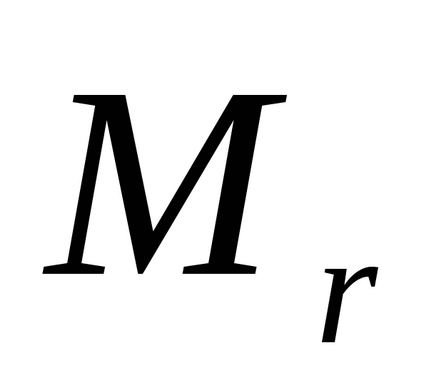
Comparați valoarea practică a greutății echivalente de magneziu E cu valoarea teoretică Et.
Se calculează procentul de experiență relativă în erori de formula:
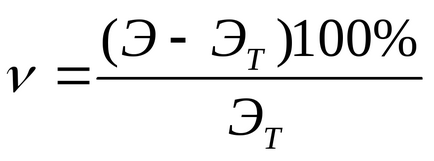
instrucţiuni de siguranță
O condiție esențială este experiența percolarea etanșeitatea întregului sistem. Ea este determinată în principal de cât de aproape dop potrivit pentru a dvuhkolennoy vitro și biuretă. La check pentru a se evita reducerea etanseitate de sticlă instrument de mână, care poate apărea atunci când apăsarea excesivă prize pe sticlă, trebuie să dvuhkolennuyu dop de flacon și biuretă să dețină un prosop.
Activitatea de laborator №2