legătură peptidică
Schema formării legăturii peptidice.
Legătura peptidică - forma legătura amidică care rezultă în timpul formării proteinelor și peptidelor care rezultă din interacțiunea grupului-α amino (-NH2) a unui aminoacid cu gruparea α-carboxil (-COOH), cu un alt aminoacid.
Dintre cei doi aminoacizi (1) și dipeptide (2) este format (un lanț de doi aminoacizi) și o moleculă de apă. Pentru aceeași schemă ribozom generează și lanțurile mai lungi de aminoacizi: polipeptide și proteine. Alți aminoacizi care sunt „blocuri“ ale unei proteine diferite radical R.
Proprietățile legăturii peptidice
Ca și în cazul oricărei legături peptidice amidă în rezonanță datorită structurilor canonice C-N legătură între atomul de carbon al grupării carbonil și atomul de azot este caracterul parțial dublu:
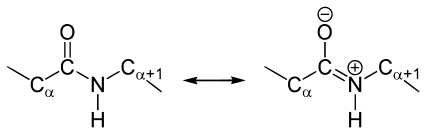
Aceasta se manifestă, în special, pentru a reduce lungimea la 1,33 Angstrom:
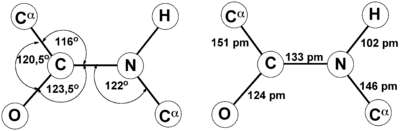
Acest lucru conduce la următoarele proprietăți:
- 4 atomi din cauza (C, N, O și H) și 2 α-carbon în același plan. R-amino grupă și α-hidrogeni la atomii de carbon sunt în afara acestui plan.
- H și O în legătura peptidică, precum și două alfa-carboni de aminoacizi sunt orientați trans (izomer trans este mai rezistent). În cazul L-aminoacizi, care are loc în toate proteinele naturale și peptide, R-grupuri sunt de asemenea trans-orientate.
- Rotație în jurul comunicării C-N este dificil, eventual rotația în jurul legăturii C-C.
Pentru detectarea proteinelor și peptidelor. și cuantificării lor, folosind reacția biuret în soluție.