Legile electronegativitate modificările și elementele dintr-un grup afișate
În această lecție veți învăța despre legile se schimbă elemente Electronegativitate în grupe și perioade. Pe aceasta vă va lua în considerare, de care depinde electronegativitatea elementelor chimice. În exemplu elementele a doua perioade de studiu modelele de schimbare a elementului electronegativitate.
Subiect: Legătura chimică. disociere electrolitica
Lecția: Modele de schimbări în electronegativitatea elementelor chimice din grup și perioada
1. Legile se schimbă valorile electronegativitate prezentate în
Regularitățile modificărilor valorilor relative Electronegativitate în perioada
Să considerăm ca exemplu elementele a doua perioade, schimbările de model în valorile electronegativitate lor relative. Fig.1.
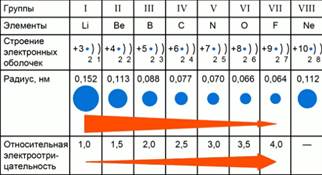
Fig. 1. Legile modifică valorile electronegativitate ale elementelor perioadei 2
Relativ element chimic electronegativitate depinde de sarcina nucleară și raza atomului. În a doua perioadă sunt elementele: Li, Be, B, C, N, O, F, Ne. De fluorură de litiu la sarcina nucleară este crescut și numărul de electroni exterioare. Numărul de straturi electronice rămâne neschimbat. Prin urmare, forța de atracție a electronilor exteriori miezului va crește, și ca atomul va fi comprimat. Raza atomului de fluorură de litiu va scădea. Raza atomică mai mică, cu atât mai puternic electronii exteriori sunt atrase de nucleu, și prin urmare o mai mare electronegativitatea relativă.
Perioada cu o creștere a încărcăturii nucleare scade raza atomică și creșterile relative electronegativitate.
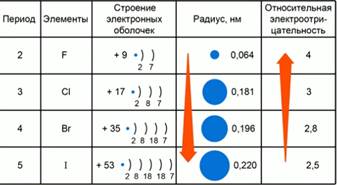
Fig. 2. Valorile Legile Electronegativitate ale elementelor schimba grupe VII-A.
2. Modele de modificări ale valorilor electronegativitate în grupul
Regularitățile modificări ale valorilor relative Electronegativitate în subgrupuri majore
Luați în considerare un model de schimbări relative electronegativitate în subgrupuri majore, de exemplu articolele de grupuri VII-A. Fig.2. În al șaptelea grup, principalele subgrupe aranjate halogen: F, CI, Br, I, At. Pe stratul exterior de electroni în aceste elemente este același număr de electroni - 7. Cu creșterea sarcină nucleu atomic în timpul tranziției de la o perioadă la alta, numărul de straturi de electroni și, prin urmare, crește raza atomică. Raza atomică mai mică, cu atât mai mare valoarea electronegativitate.
Principalul subgrupul cu creșterea nucleului atomic taxa crește raza atomică și scade electronegativitatea relativă.
Deoarece fluorul element chimic este situat în colțul din dreapta sus al Sistemului D. Periodic I.Mendeleeva valoarea electronegativitate relativă este maximă și egală cu 4.
Concluzie: relative crește electronegativitate cu scăderea razei atomului.
În perioadele cu creștere de sarcină nucleu atomic crește electronegativitate.
Subgrupele majore cu o creștere a nucleului atomic taxa element chimic electronegativitate relativă scade. Elementul chimic cel mai electronegativ - este fluor, deoarece este situat în colțul din dreapta sus al D. I.Mendeleeva periodic.
Rezumând rezultatul lecției
În această lecție ați învățat despre legile se schimbă elemente Electronegativitate în grupe și perioade. Pe aceasta ați examinat ceea ce determină electronegativitatea elementelor chimice. In exemplu elementele doua modele de schimbare perioadei studiate elementul electronegativitate.
Lista de lecturi
Link-uri recomandate la resurse online
temele recomandate
2 furnizează exemple de substanțe nepolare cu covalente și legătură ionică. Ce electronegativitatea în formarea acestor compuși?
3. Se pun într-o serie de elemente ascendente electronegativitate din al doilea grup a grupului principal.
Se încarcă.
Trebuie să descărcați planurile de lecție pe tema „Modele de schimbare în electronegativitatea elementelor în grupe și perioade. link-ul hold
Se încarcă.
lucrari populare
- Peisaje în versurile S.Pushkina
- Analiza Blok poem „în câmpul Kulikovom“
- Tată și fiu în poveste D. Aldridge "The Last Inch"
- Viața și opera lui Goethe VI
- Deciziile tribunalului de arbitraj. sarcini
- Proiectare de catering de proiectare restaurant. partea 2
- A. și S. S.Pushkin A.Esenin naturii Rusă
-
proiect Statistica