Metode de modificare a energiei interne
energia internă poate fi modificată în două moduri.
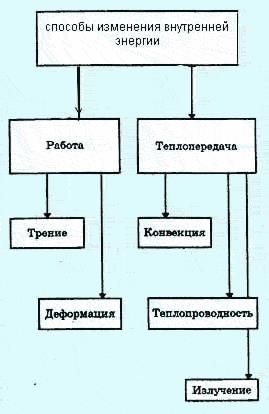
În cazul în care locul de muncă se face pe corp, creste sale interne de energie.
Energia internă a corpului (denumit E sau U) - este suma energiilor interacțiunilor moleculare și mișcările termice ale moleculelor. Energia internă este o funcție unică a stării sistemului. Acest lucru înseamnă că, de fiecare dată când sistemul este în această stare, energia sa internă ia valoarea intrinsecă a acestui stat, indiferent de istoria sistemului. În consecință, modificarea internă a energiei în tranziția de la o stare la alta va fi întotdeauna egală cu diferența dintre valorile din statele sale finale și inițiale, indiferent de calea pe care se face trecerea.
Energia internă a corpului nu poate fi măsurat direct. Puteți determina doar modificarea energiei interne:
- - a rezumat la temperatura corpului, măsurată în jouli
- [1] - activitatea desfășurată de către organismul împotriva forțelor externe, măsurată în jouli
Această formulă este expresia matematică a primei legi a termodinamicii
Pentru procese cvasistatice următoarea relație:
- temperatura, măsurată în grade Kelvin
- entropie, măsurată în jouli / kelvin
- presiunea măsurată în pascali
- numărul de particule din sistem
Căldura de ardere a combustibilului. Combustibil convențional. Cantitatea de aer necesară pentru arderea combustibilului.
Pe un combustibil este judecat de valoarea sa calorică. Pentru caracterizarea combustibililor solizi și lichizi este căldura specifică a indicelui de ardere care reprezintă cantitatea de căldură generată prin arderea completă a unei mase unitate (kJ / kg). Pentru combustibili gazoși, viteza de ardere utilizat volumul de căldură, care este cantitatea de căldură generată de ardere per unitate de volum (kJ / m3). În plus, combustibilul gazos este, în unele cazuri evaluate de numărul de căldura generată de arderea completă a unui mol de gaz (kJ / mol).
Căldura de combustie este determinată nu numai teoretic, ci și experimental, o anumită cantitate de combustibil care arde în dispozitive speciale, numite calorimetre. Căldura de combustie este evaluată prin creșterea temperaturii apei din colorimetru. Rezultatele obținute prin această metodă este aproape de valorile calculate din compoziția elementară a carburantului.
energie internă Q 14Izmenenie prin încălzire și răcire. Lucrul cu gaz la schimbarea volumului.
Energia internă a corpului depinde de energia cinetică medie a moleculelor sale și această energie este, la rândul său, depinde de temperatura. Prin urmare, modificarea temperaturii corpului, si vom schimba corpul de încălzire intern energiyu.Pri energia internă este crescută prin răcire este redusă.
Energia internă a corpului poate fi modificat fără a efectua munca. De exemplu, ea poate fi crescută, placa de încălzire de pe fierbătorul cu apă sau omitand lingura într-un pahar de ceai fierbinte. Încălzit de un șemineu, în cazul în care un foc de cărbuni, acoperișul casei, iluminate de soare, și așa mai departe. D. O creștere a temperaturii corpurilor în toate aceste cazuri, reprezintă o creștere a energiei interne, dar această creștere este fără muncă.
Modificarea energiei interne a corpului fără loc de muncă este numit transfer de căldură. Schimbul de căldură are loc între corpurile (sau părți ale aceluiași corp) cu temperaturi diferite.
Ca atare, transferul de căldură are loc prin contactul lingurii rece cu apă caldă? În primul rând, viteza medie și energia cinetică a moleculelor de apă caldă depășește viteza medie și energia cinetică a particulelor de metal din care se face lingura. Dar, în acele locuri în care lingura este în contact cu apa, moleculele de apă caldă începe să transfere o parte din energia lor cinetică a particulelor lingurile, și ei încep să se miște mai repede. Energia cinetică a moleculelor de apă scade, iar energia cinetică a particulelor crește linguri. Împreună cu schimbările de energie și de temperatura: apa se răcește treptat și se încălzește lingura. Schimbarea temperaturile lor are loc atât timp cât și apa, iar lingura nu va mai fi la fel.
O parte din energia internă transmise de la un corp la altul în timpul transferului de căldură, notate cu litere nazyvayutkolichestvom și căldură.
Q - cantitatea de energie termică.
Cantitatea de căldură nu trebuie confundat cu temperatura. Temperatura se măsoară în grade, iar cantitatea de căldură (precum și orice altă energie) - în jouli.
La corpurile de contact cu temperatura corpului diferite mai fierbinte trimite o anumită cantitate de căldură și mai rece devine organism.
Utilizarea sub gaz de expansiune izobară. Unul dintre procesele termodinamice de bază care apar în majoritatea motoarelor termice, un proces de expansiune a gazelor cu munca. Este ușor să se determine activitatea din gazul de expansiune izobară.
Când are loc expansiunea izobară a gazului din V1 volum la volum V2 piston se deplasează în cilindru la o distanță l (Fig. 106), lucrarea A“, un gaz perfect, este
unde p - presiunea gazului - modificări ale volumului.
Operarea la un gaz arbitrar proces de extindere. Arbitrare proces de expansiune a gazelor pe V1 volum la volum V2 poate fi reprezentat ca un set de procese alternative izobare și izocoră.
De lucru în timpul expansiunii izoterma a gazului. Comparând zonele cultivate cu porțiuni din formele izoterme și isobars, se poate concluziona că expansiunea gazului din V1 volum la volum V2 la aceeași valoare inițială a presiunii gazului în caz este însoțit de comisia de expansiune izobară mai mult de lucru.
Lucrul comprimare a gazelor. Atunci când extinderea vector direcția de gaz a forței de presiune a gazului coincide cu direcția vectorului de deplasare, astfel încât lucrarea A“, un gaz perfect este pozitiv (A«> 0), iar lucrarea A forțe externe negative: A = -A» <0.
Când comprimat vector direcția de gaz a forței externe coincide cu direcția de deplasare, astfel încât activitatea A forțe pozitive externe (A> 0) și activitatea A „un gaz perfect, negativ (A“ <0).
proces adiabatic. Pe lângă procesele izobare, izocoră și izoterme, termodinamica considerate de multe ori procese adiabatice.
proces adiabatic este un proces care are loc într-un sistem termodinamic în absența schimbului de căldură cu organele din jur, adică. E. Sub starea Q = 0.
Întrebarea 15 Condițiile de echilibru al corpului. Momentul de forță. Tipuri de echilibru.
Sold, sau de echilibru, un anumit număr de fenomene conexe în științele naturale și umaniste.
Sistemul este considerat a fi în echilibru, dacă totul în sistem este compensat de alte efecte, sau inexistentă. Un concept similar - stabilitate. Equilibrium poate fi stabilă, instabilă sau indiferente.
Exemple tipice de echilibru:
1. Echilibrul mecanic, de asemenea, cunoscut sub numele de echilibru static - starea corpului în repaus sau de mișcare uniform, în care suma forțelor și momentelor care acționează pe ea este zero.
2. echilibru chimic - o poziție în care ia reacția chimică loc în aceeași măsură ca și reacția inversă, și ca urmare nu se modifică valoarea fiecărei componente.
3. Echilibrul fizic al oamenilor și a animalelor, care este menținută de o înțelegere a necesității sale și, în unele cazuri - cu ajutorul întreținerii artificiale a acestui echilibru [sursa care nu este specificat 948 zile].
4. echilibru termodinamic - starea sistemului în care procesele sale interne nu conduc la modificări ale parametrilor macroscopici (cum ar fi temperatura și presiunea).
P avenstvo zero, suma algebrică a momentelor de forțe nu, de asemenea, înseamnă că, în timp ce corpul este în repaus este necesară. De-a lungul a miliarde de ani, cu o perioadă constantă continuă în jurul axei de rotație a Pământului, tocmai pentru că suma algebrică a momentelor forțelor care acționează asupra Pământului de la alte organisme, este foarte mic. Din același motiv, aceasta continuă să se rotească la o roată de bicicletă untwisted frecvență constantă, și numai forțele externe opresc această rotație.
Tipuri de echilibru. În practică, joacă un rol important nu numai punerea în aplicare a condițiilor de echilibru a corpurilor, ci și caracteristicile calitative ale echilibrului, numit rezistența. Există trei tipuri de echilibru tel: stabil, instabil și indiferenți. Echilibrul este numit stabil în cazul în care după un anumit corp influențe externe revine la starea sa inițială de echilibru. Acest lucru are loc atunci când o ușoară deplasare a corpului în orice direcție față de poziția inițială a forței rezultante care acționează asupra unui corp, este diferit de zero și este îndreptată spre poziția de echilibru. Echilibrul stabil este, de exemplu, o minge în partea inferioară a locașului.
Starea generală a echilibrului corp. Combinând cele două terminale pot fi formulate starea generala echilibrul corpului: corpul este în echilibru, dacă geometric suma vectorială zero a tuturor forțelor aplicate acestuia și suma algebrică a momentelor acestor forțe în jurul axei de rotație.
Intrebare 16Paroobrazovanie și condensare. Evaporarea. lichid de fierbere. Dependența presiunii fluidului de fierbere.
Vaporizarea - picăturii de proprietate pentru a schimba starea fizică și se transformă în abur. Vaporizarea care apare numai pe suprafața picăturii se numește evaporare. Vaporizarea în jurul valorii de volumul de lichid se numește punct de fierbere; aceasta are loc la o temperatură specifică, care depinde de presiunea. Presiunea la care lichidul fierbe la o temperatură dată, numita presiune a vaporilor pnp, valoarea sa depinde de tipul de fluid și temperatura acestuia.
Evaporarea - procesul de tranziție a unei substanțe dintr-un lichid în stare gazoasă (abur). Procesul de evaporare este procesul invers de condensare (trecerea de la vapori de la evaporarea lichidului (vaporizarea), tranziția de la o substanță condensată (solid sau lichid), în fază gazoasă (abur). În primul rând, pentru faza de tranziție.
Condensul - un proces de evaporare proces invers. Când moleculele de vapori se condensează înapoi la un lichid. Într-un vas închis un lichid și vaporii săi pot fi în echilibru dinamic, numărul de molecule, care ies din lichid, egal cu numărul de molecule, revenind din vaporii unui lichid, adică atunci când viteza proceselor de evaporare și condensare sunt identice. Un astfel de sistem se numește în două faze. Vaporii în echilibru cu lichidul său, numit saturat. Numărul de molecule care scapă suprafața lichidului a unităților pătrat pe secundă, în funcție de temperatura lichidului. Numărul de molecule, revenind la vaporii lichidului depinde de concentrația moleculelor de vapori și viteza medie a mișcării lor termice, care este determinată de temperatura vaporilor.
Fierberea - procesul de vaporizare în lichid (tranziția unei substanțe dintr-un lichid în stare gazoasă), cu apariția limitelor de separare a fazelor. Punct de fierbere la presiunea atmosferică este de obicei ca una dintre principalele caracteristici fizico-chimice ale substanței pure chimic.
Se fierbe disting în funcție de tipul:
1. în convecție liberă de fierbere într-o cantitate mare;
2. se fierbe sub convecție forțată;
3 precum și în raport cu temperatura medie a temperaturii de saturație lichid:
4. fierberea lichidului, subrăcit la o temperatură de saturație (suprafață de fierbere);
5. Temperatura de fierbere a fluidului până dogretoy saturație
Se fierbe în care aburul este generat în formă de bule și creșterea periodicheskizarozhdayuschihsya numit fierberea de nucleu. La fierbere lentă de nucleu lichid (sau, mai degrabă, de obicei, pe pereții sau pe fundul vasului) apar bule umplute cu abur. Datorită evaporarea intensă a lichidului în interiorul bule cresc plutesc în sus, iar aburul este eliberat în faza de vapori deasupra lichidului. In lichidul din stratul limită este ușor supraîncălzit, adică. E. Temperatura sa depășește punctul de fierbere nominal. În condiții normale, această diferență este mică (pe ordinea de un grad).
Prin creșterea fluxului de căldură la o anumită valoare critică a bulelor individuale coaguleze pentru a forma un perete recipient continuu în stratul de vapori, erupe periodic în lichidul în vrac. Aceasta se numește dejucată.