Proprietățile de acid azotic, preparare și utilizare

Acidul azotic (formula HNO3) este un acid puternic monobazic. Statul neoxîdâți, se pare că în fotografie 1. În condiții normale, este un lichid, dar poate fi transformată într-o stare de agregare solidă. Și acolo amintește cristale cu un grilaj monoclinică sau rombică.
Proprietățile chimice ale acidului azotic

Pentru amoniac sintetic de acid azotic este oxidat cu ajutorul unui catalizator de platină-rodiu înainte ca amestecul de gaze nitroase, care sunt ulterior absorbite de apă. se formează, de asemenea, atunci când amestecarea și încălzirea nitrat de fier și sulfat de potasiu.

Cu îngrășăminte care produc acid azotic, explozivi și unele otrăvuri. Este placi (sablata bord gravură pad de magneziu, etc.), și chiar și tonifiere soluții acidulate pentru fotografie. Din produc coloranți acid azotic și medicamente, precum și cu ajutorul ei determină prezența aurului din aliajele de aur.
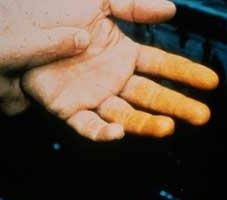
Având în vedere gradul de influența acidului azotic asupra organismului, este clasificat treia clasa de pericol (moderat periculos). Inhalarea vaporilor sale provoacă iritația tractului respirator. După contactul cu acid azotic pielea lasă mult de o lungă perioadă de timp pentru a vindeca ulcere. piele, în cazul în care ea a fost de a deveni o culoare galbenă caracteristică (vezi foto). Științific vorbind, există ksantoproteinovaya reacție. dioxid de azot, care se obține prin încălzirea cu acid azotic sau descompunerea acesteia în lumină, este foarte toxic si poate provoca edem pulmonar.
Acidul azotic este benefic pentru om ca pentru a dilua și curat. Dar cel mai adesea se găsește în compoziția substanțelor, dintre care multe s-ar putea să fie familiarizați cu (cum ar fi nitroglicerina).